आम्ल, आम्लारी व क्षार स्वाध्याय इयत्ता नववी विज्ञान आणि तंत्रज्ञान

1. गटात न बसणारा शब्द ओळखा व कारण द्या.
अ. क्लोराइड, नायट्रेट, हायड्राइड, अमोनिअम
उत्तर :
अमोनियम
कारण : अमोनिअम हे आम्लारिधर्मी मूलक आहे, इतर सर्व आम्लधर्मी मूलके आहेत.
आ. हायड्रोजन क्लोराइड, सोडिअम हायड्रॉक्साइड, कॅल्शिअम ऑक्साइड, अमोनिआ
उत्तर :
हायड्रोजन क्लोराइड
कारण : हायड्रोजन क्लोराइड पाण्यात विरघळल्यास H+ आयनांची निर्मिती होते, इतर सर्व OH– आयनांची निर्मिती करतात.
इ. अँसेटिक अँसिड, कारबॉनिक अँसिड, हायड्रोक्लोरीक अँसिड, नायट्रिक अँसिड
उत्तर :
कारबॉनिक अँसिड
कारण : कारबॉनिक अँसिड द्विआम्लारीधर्मी आहे, इतर सर्व एक आम्लारिधर्मी आहेत.
ई. अमोनियम क्लोराइड, सोडिअम क्लोराइड, पोटॅशिअम नायट्रेट, सोडियम सल्फेट
उत्तर :
अमोनियम क्लोराइड
कारण : अमोनियम क्लोराइड हा आम्लधर्मीक्षार आहे, इतर सर्व उदासीन क्षार आहेत.
उ. सोडिअम नायट्रेट, सोडिअम कार्बोनेट, सोडिअम सल्फेट, सोडिअम क्लोराइड
उत्तर :
सोडिअम कार्बोनेट
कारण : सोडिअम कार्बोनेट हा आम्लारिधर्मी क्षार आहे, इतर सर्व उदासीन क्षार आहेत.
ऊ. कॅल्शिअम ऑक्साइड, मॅग्नशिअम ऑक्साइड, झिंक ऑक्साइड, सोडिअम ऑक्साइड
उत्तर :
झिंक ऑक्साइड
कारण : झिंक ऑक्साइड हे उभयधर्मी (आम्लधर्मी व आम्लारीधर्मी) ऑक्साइड आहे, इतर सर्व आम्लारीधर्मी ऑक्साइड्स आहेत.
ए. स्फटिकरूप मोरचूद, स्फटिकरूप मीठ, स्फटिकरूप फेरस सल्फेट, स्फटिकरूप सोडिअम कार्बोनेट
उत्तर :
स्फटिकरूप मीठ
कारण : स्फटिकरूप मिठामध्ये स्फटिकजल नसते, इतर सर्व घटकांत स्फटिकजल असते.
ऐ. सोडिअम क्लोराइड, पोटॅशिअम हायड्रॉक्साइड, अँसेटिक अँसिड, सोडिअम अँसिटेट
उत्तर :
अँसेटिक अँसिड
कारण : अँसेटिक अँसिड सौम्य विद्युत अपघटनी पदार्थ आहे, तर इतर सर्व प्रबल विद्युत अपघटनी पदार्थ आहेत.
2. पुढील कृती केल्यावर काय बदल दिसतील ते लिहून त्यामागील कारण स्पष्ट करा.
अ. कॉपर सल्फेटच्या 50 मिली द्रावणात 50 मिली पाणी मिळवले.
उत्तर :
i) कुठल्याही द्रावणात पाणी मिळवल्यास द्रावणाची संहती कमी होते.
ii) जर कॉपर सल्फेटच्या 50 मिली द्रावणात तितकेच म्हणजे 50 मिली पाणी मिळवल्यास कॉपर सल्फेटची संहती कमी होऊन ते विरल होईल.
iii) द्रावणाचा रंग हलका होईल. निळा रंग हलका निळा होईल.
आ. सोडिअम हायड्रॉक्साइडच्या 10 मिली द्रावणात फिनाॅलफ्थॅलीन दर्शकाचे दोन थेंब टाकले.
उत्तर :
i) फिनाॅल्फ्थॅलीन दर्शक कुठल्याही द्रावणात टाकल्यास तेथे रासायनिक अभिक्रिया होऊन द्रावणाचा रंग बदलतो.
ii) त्याकारणानेच जर सोडिअम डायड्रॉक्साइडच्या 10 मिली द्रावणात फिनाॅल्फ्थॅलीन दर्शकाचे दोन थेंब टाकल्यास द्रावणाचा रंग गुलाबी होईल.
इ. 10 मिली विरल नायट्रिक अँसिडमध्ये तांब्याच्या किसाचे 2/3 कण टाकून हलवले.
उत्तर :
i) तांब्याचा काही किस विरल नायट्रिक अँसिडमध्ये टाकल्यास तांब्याची नायट्रिक अँसिडमधल्या NO3– मूलकाशी रासायनिक अभिक्रिया होते.
ii) या अभिक्रियेच्या परिणामी कॉपर नायट्रेडचे द्रावण तयार होऊन हायड्रोजन वायू मुक्त होतो.
ई. 2 मिली विरल HCl मध्ये लिटमस कागदाचा तुकडा टाकला. त्यानंतर त्यामध्ये 2 मिली संहत NaOH मिळवून हलवले.
उत्तर :
i) लिटमस कागद संश्लिष्ट दर्शक आहे.
ii) 2 मिली विरल HCl मध्ये लिटमस कागदाचा तुकडा टाकल्यास HCl आम्लधर्मी असल्याने निळा लिटमस लाल होतो.
iii) त्यानंतर जर त्यात 2 मिली संहत NaOH मिळवल्यास NaOH च्या आम्लारी गुणधर्मामुळे लाल लिटमस निळा होईल.
उ. विरल HCl मध्ये मॅग्नेशिअम ऑक्साइड मिळवले तसेच विरल NaOH मध्ये मॅग्नेशिअम ऑक्साइड मिळवले.
उत्तर :
i) HCl हे आम्लधर्मी आहे. तसेच NaOH आणि मॅग्नेशिअम ऑक्साइड आम्लारिधर्मी आहे.
ii) विरल HCl आम्लधर्मी असल्याने आम्लारिधर्मी मॅग्नेशिअम ऑक्साइडशी त्याचे उदासीकरण होऊन मॅग्नेशिअम क्लोराइड हे मीठ व पाणी तयार होते.
iii) आम्लारी गुणधर्मामुळे मॅग्नेशिअम ऑक्साइडची विरल NaOH या आम्लारिधर्मी संयुगाशी कुठलीही रासायनिक अभिक्रिया होत नाही.
ऊ. विरल HCl मध्ये झिंक ऑक्साइड मिळवले तसेच विरल NaOH मध्ये झिंकऑक्साइड मिळवले.
उत्तर :
i) विरल HCl मध्ये झिंक ऑक्साइड मिळवले तेव्हा झिंक क्लोराइड व पाणी तयार होते. या अभिक्रियेमध्ये झिंक ओक्साइड हे आम्लारीधर्मी आहे.
ii) विरल NaOH मध्ये झिंक ऑक्साइड मिळवले तेव्हा सोडिअम झिंकेट (Na2ZnO2) व पाणी तयार होते. या अभिक्रियेमध्ये झिंक ऑक्साइड हे आम्लधर्मी आहे.
iii) म्हणजेच झिंक ऑक्साइड हे उभयधर्मी ऑक्साइड आहे.
ए. चुनखडीवर विरल HCl टाकले.
उत्तर :
चुनखडीवर विरल HCl टाकले तेव्हा आम्ल-आम्लारी उदासीकरणाची अभिक्रिया होऊन कॅल्शिअम क्लोराइड व पाणी तयार होते आणि CO2 वायू मुक्त होतो. या अभिक्रियेत चुनखडी ही आम्लारीधर्मी आहे.
ऐ. परीक्षानळीत मोरचुदाचे खडे तापवले व थंड झाल्यावर त्यात पाणी मिळवले.
उत्तर :
i) परीक्षानळीत मोरचुदाचे खडे तापवले तेव्हा मोरचुदाची स्फटिक संरचना मोडून रंगहीन (पांढरे) चूर्ण तयार होते व पाण्याचे बाष्प होऊन निघून जाते.
ii) थंड झाल्यावर या चूर्णात पाणी ओतले असता पुन्हा निळ्या रंगाचे मोरचूद तयार होते.
म्हणजेच हे सर्व बदल भौतिक बदल आहेत.
ओ. विद्युत अपघटनी घटात विरल H2SO4 घेऊन त्यातून वीजप्रवाह जाऊ दिला.
उत्तर :
विद्युत अपघटनी घटात विरल H2SO4 घेऊन त्यातून विद्युतप्रवाह जाऊ दिला तेव्हा विरल H2SO4 मध्ये H+ व SO42- हे आयन विचरणामुळे तयार होतात. या आयनांद्वारे विद्युतधारा वाहून नेली जाते. यात ऋणाग्रापाशी हायड्रोजन वायू तयार होतो, तर धनाग्रापाशी ऑक्सिजन वायू तयार होतो.
3. खालील ऑक्साइडचे तीन गटात वर्गीकरण करून त्यांना नावे द्या.
CaO, MgO, CO2, SO3, Na2O, ZnO, Al2O3, Fe2O3
उत्तर :
| आम्लधर्मी ऑक्साईड | आम्लारीधर्मी ऑक्साईड | उभयधर्मी ऑक्साईड |
|---|---|---|
| CO2, SO3 | CaO, MgO, Na2O | ZnO , Al2O3, Fe2O3 |
4. इलेक्ट्रॉन संरूपण आकृती काढून स्पष्ट करा.
अ. सोडिअम व क्लोरीनपासून सोडिअम क्लोराइडची निर्मिती
उत्तर :
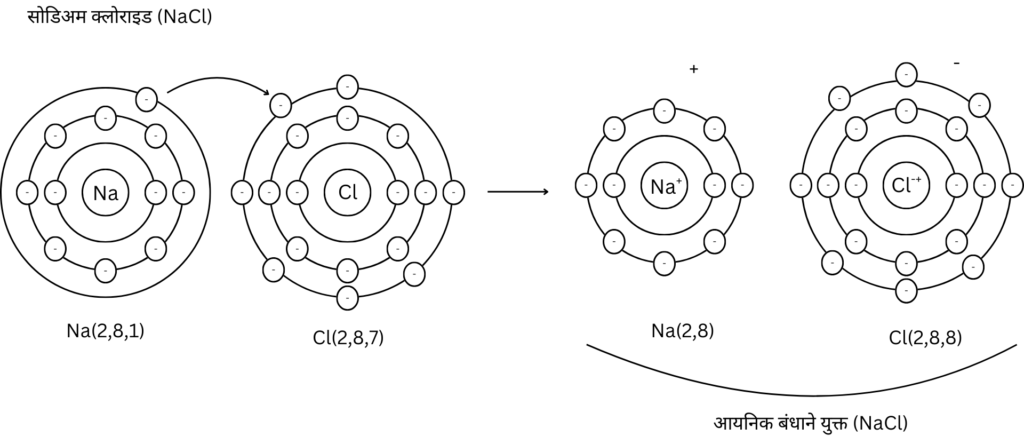
i) सोडिअमचे इलेक्ट्रॉनिक संरूपण (2,8,1) आणि क्लोरीनचे इलेक्ट्रॉनिक संरूपण (2,8,7) आहे.
ii) अष्टक पूर्ण करण्यासाठी सोडिअम अणू बाह्यतम कक्षेतील एका इलेक्ट्रॉन गमावून Na+ आयन तयार करतो.
iii) याच वेळी अष्टक पूर्ण करण्यासाठी क्लोरीन अणू बाह्यतम कक्षेत एकेक इलेक्ट्रॉन मिळवून Cl– आयन तयार करतो.
iv) सोडिअमचा धन आयन (Na+) व क्लोरीनचा ऋण आयन (Cl–) यांमधील विद्युत स्थितिक आकर्षणामुळे त्यांमध्ये आयनिक बांध तयार होऊन सोडिअम क्लोराइड (NaCl) तयार होते.
आ. मॅग्नेशिअम व क्लोरीनपासून मॅग्नेशिअम क्लोराइडची निर्मिती
उत्तर :
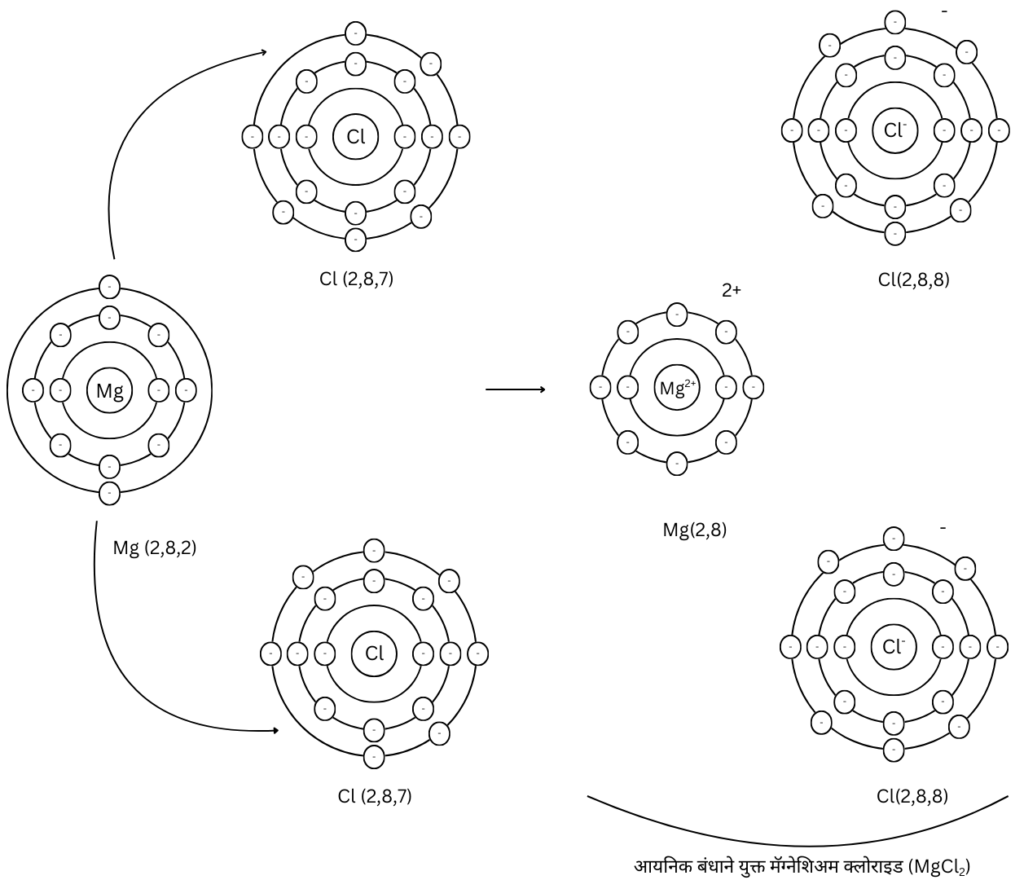
i) मॅग्नेशिअमचे इलेक्ट्रॉनिक संरूपण (2,8,2) आणि क्लोरीनचे इलेक्ट्रॉनिक संरूपण (2,8,7) आहे.
ii) अष्टक पूर्ण करण्यासाठी मॅग्नेशिअम अणू बाह्यतम कक्षेतील दोन इलेक्ट्रॉन गमावून Mg2+ आयन तयार करतो.
iii) याच वेळी अष्टक पूर्ण करण्यासाठी क्लोरीनचा प्रत्येक अणू बाह्यतम कक्षेत एकेक इलेक्ट्रॉन मिळवून Cl– आयन तयार करतो.
iv) मॅग्नेशिअमचा धन आयन (Mg2+) व क्लोरीनचे ऋण आयन (Cl–) यांमधील विद्युत स्थितिक आकर्षणामुळे त्यांमध्ये आयनिक बंध तयार होऊन मॅग्नेशिअम क्लोराइड (MgCl2) तयार होते.
5. खालील संयुगे पाण्यात विरघळल्यास त्यांचे विचरण कसे होते ते रासायनिक समीकरणाने दर्शवा व विचरणाचे प्रमाण कमी की जास्त ते लिहा.
हायड्रोक्लोरिक आम्ल, सोडिअम क्लोराइड, पोटॅशिअम हायड्राॅक्साइड, अमोनिआ, अँसेटिक आम्ल, मॅग्नेशिअम क्लोराइड, कॉपर सल्फेट
उत्तर :

6. पुढील द्रावणाची संहती ग्रॅम/लीटर व मोल/लिटर हया एककांमध्ये व्यक्त करा.
अ. 100 मिली द्रावणात 7.3 ग्रॅम HCl
आ. 50 मिली द्रावणात 2 ग्रॅम NaOH
इ. 100 मिली द्रावणात 3 ग्रॅम CH3COOH
ई. 200 मिली द्रावणात 4.9 ग्रॅम H2SO4
उत्तर :
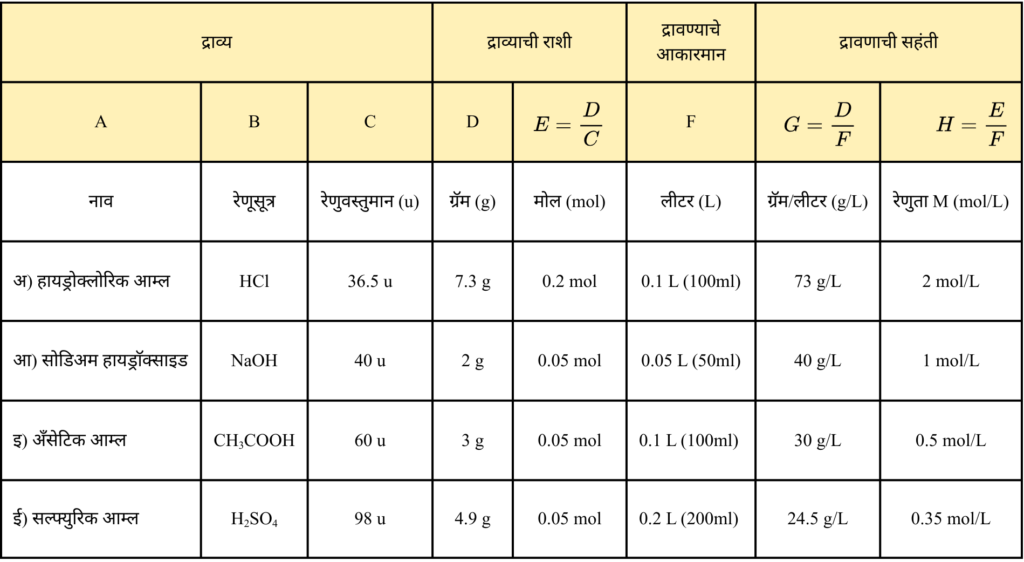
7. खालील प्रश्नांची उत्तरे लिहा.
अ. आम्लारिधर्मता ह्या गुणधर्मानुसार आम्लांचे वर्गीकरण करा. प्रत्येकी एक उदाहरण लिहा.
उत्तर :
आम्लारिधर्मता या गुणधर्मानुसार (आम्लाच्या एका रेणूपासून विचरणाने जितके H+ आयन मिळू शकतात त्या संख्येनुसार) आम्लांचे एक आम्लारिधर्मी, द्विआम्लारिधर्मी व त्रिआम्लारिधर्मी असे तीन प्रकार पडतात.
एक आम्लारिधर्मी आम्ल : HCl
द्विआम्लारिधर्मी आम्ल : H2SO4
त्रिआम्लारिधर्मी आम्ल : H3SO4
आ. उदासिनीकरण म्हणजे काय ? दैनंदिन जीवनातील उदासिनीकरणाची दोन उदाहरणे लिहा.
उत्तर :
आम्लाची आम्लारीशी अभिक्रिया केली असता, क्षार व पाणी तयार होते. या क्रियेला उदासिनीकरण अभिक्रिया म्हणतात.
उदा : HCl (आम्ल) + NaOH (आम्लारी) → NaCl (क्षार) + H2O (पाणी)
दैनंदिन जीवनातील उदासिनीकरणाची उदाहरणे :
i) जेव्हा पोटातील आम्लाचे प्रमाण वाढले तेव्हा ते उदासीन करण्यासाठी आम्लारी असलेली आम्ल प्रतिबंधक औषधे दिली जातात, आम्लप्रतिबंधक औषधामुळे जठरात तयार झालेल्या अधिक आम्लाचे उदासिनीकरण होते.
ii) दातांमध्ये राहिलेल्या अन्नकणांचे विघटन होऊन दातांमध्ये आम्ल तयार होते, त्यामुळे दात किडू शकतात, म्हणून आपण टूथपेस्टने दात घासतो. ही टूथपेस्ट आम्लारी स्वरूपाची असते आणि आम्लाला उदासीन करते.
इ. द्रावणाचा सामू मोजण्यासाठी कोणत्या पद्धती वापरतात ते लिहा.
उत्तर :
द्रावणाचा सामू मोजण्याच्या पद्धती :
i) सामू मापक (pH meter)
ii) सामू मापन श्रेणी (pH Scale)
iii) वैश्विक दर्शकाचे द्रावण/सामू दर्शक कागदी पट्ट्या
iv) नैसर्गिक, तसेच संश्लिष्ट दर्शक
ई. पाण्याचे विद्युत अपघटन म्हणजे काय ते सांगून विद्युतअग्र अभिक्रिया लिहून स्पष्ट करा.
उत्तर :
आम्लयुक्त किंवा आम्लारीयुक्त पाण्यातून विद्युतधारा जाऊ दिली असता त्याचे पृथक्करण होऊन ऋणाग्रापाशी हायड्रोजन वायू तयार होतो व धनाग्रापाशी ऑक्सिजन वायू तयार होतो. यालाच पाण्याचे विद्युत अपघटन म्हणतात.
ऋणाग्र अभिक्रिया : 2H2O + 2e– → H2 (g) + 20H– (aq)
धनाग्र अभिक्रिया : 2H2O → O2 (g) + 4H+ (aq) 4e–
8. खालील कृतीसाठी रासायनिक समीकरणे लिहा.
अ. HCl च्या द्रावणात NaOH चे द्रावण मिळवले.
उत्तर :
HCl (aq) (हायड्रोक्लोरिक आम्ल) + NaOH (aq) (सोडिअम हायड्राॅक्साइड) → NaCl (aq) (सोडिअम क्लोराइड) + H2O (I) (पाणी)
आ. विरल H2SO4 मध्ये जस्ताचे चूर्ण मिळवले.
उत्तर :
Zn (s) झिंक (जस्त) + H2SO4 (aq) (सल्फ्युरिक आम्ल) → ZnSO4 (aq) (झिंक सल्फेट) + H2 (g) (हायड्रोजन)
इ. कॅल्शिअम ऑक्साइड मध्ये विरल नायट्रिक अँसिड मिळवले.
उत्तर :
CaO (s) (कॅल्शिअम ऑक्साईड) + 2HNO3 (aq) (नायट्रिक अँसिड (विरल)) → Ca(NO3)2 (aq) कॅल्शिअम नायट्रेट + H2O (I) (पाणी)
ई. KOH च्या द्रावणामधून कार्बन डायऑक्साइड वायू सोडला.
उत्तर :
CO2 (g) (कार्बन डायऑक्साईड) + 2KOH (aq) (पोटॅशिअम हायड्रॉक्साइड) → K2CO3 (aq) (पोटॅशियम कार्बोनेट) + H2O (I) (पाणी)
उ. खाण्याच्या सोड्यावर विरल HCl ओतले.
उत्तर :
NaHCO3 (s) (सोडिअम बायकार्बोनेट (खाण्याचा सोडा)) + HCl (aq) (हायड्रोक्लोरिक आम्ल (विरल)) → NaCl (aq) सोडिअम क्लोराईड + H2O (I) (पाणी) + CO2 (g) (कार्बन डायऑक्साईड)
9. फरक लिहा.
अ. आम्ल व आम्लारी
उत्तर :
| आम्ल | आम्लारी |
|---|---|
| i) आम्ल चवीला आंबट असते. | i) आम्लारी चवीला कडू असते. |
| ii) आम्लामुळे निळा लिटमस पेपर लाल होतो. | ii) आम्लारी मुळे लाल लिटमस पेपर निळा होतो. |
| iii) आम्लधर्मी द्रावणाचा सामू 7 पेक्षा कमी असतो. | iii) आम्लारीधर्मी द्रावणाचा सामू 7 पेक्षा जास्त असतो. |
| iv) उदा : HCl, H2SO4 इत्यादी. | iv) उदा : NaOH, KOH इत्यादी. |
आ. कॅटायन व अँनायन
उत्तर :
| कॅटायन | अँनायन |
|---|---|
| i) धनप्रभारित आयनांना कॅटायन म्हणतात. | i) ऋणप्रभारित आयनांना अँनायन म्हणतात. |
| ii) कॅटायनला आम्लारीधर्मी मूलक असेही म्हणतात. | ii) अँनायनला आम्लधर्मी मूलक असेही म्हणतात. |
| iii) जेव्हा उदासीन अणू इलेक्ट्रॉन देतो, तेव्हा कॅटायन तयार होते. | iii) जेव्हा उदासीन अणू इलेक्ट्रॉन घेतो, तेव्हा अँनायन तयार होते. |
| iv) उदा : Na+, Cu2+ इत्यादी. | iv) उदा : Cl–, Br– इत्यादी. |
इ. ऋणाग्र व धनाग्र
उत्तर :
| ऋणाग्र | अँनायन |
|---|---|
| i) ऋणप्रभारित इलेक्ट्रोडला ऋणाग्र म्हणतात. | i) धनप्रभारित इलेक्ट्रोडला धनाग्र म्हणतात. |
| ii) कॅटायन ऋणाग्राकडे आकर्षिले जातात. | ii) अँनायन धनाग्राकडे आकर्षिले जातात. |
| iii) ऋणाग्रापाशी इलेक्ट्रॉन दिले जातात. | iii) धनाग्रापाशी इलेक्ट्रॉन स्वीकारले जातात. |
10. खालील पदार्थाच्या जलीय द्रावणाचे वर्गीकरण सामूप्रमाणे 7, 7 पेक्षा जास्त व 7 पेक्षा कमी या गटांत करा.
मीठ, सोडिअम अँसिटेट, हायड्रोजन क्लोराइड, कार्बन डायऑक्साइड, पोटॅशिअम ब्रोमाइड, कॅल्शिअम हायड्रॉक्साइड, अमोनिअम क्लोराइड, व्हिनेगार, सोडिअम कार्बोनेट, अमोनिआ, सल्फर डायऑक्साइड
उत्तर :
| सामू | पदार्थाचे द्रावण |
|---|---|
| 7 | मीठ, पोटॅशिअम ब्रोमाइड |
| 7 पेक्षा जास्त | सोडिअम अँसिटेट, कॅल्शिअम हायड्रॉक्साइड, सोडिअम कार्बोनेट, अमोनिआ |
| 7 पेक्षा कमी | हायड्रोजन क्लोराइड, कार्बन डायऑक्साइड, अमोनिअम क्लोराइड, सल्फर डायऑक्साइड |
